Home > Scuola > Teoria > L’energia chimica
L’energia chimica è una forma di energia “intrappolata” nei legami chimici all’interno delle molecole. Per dimostrare che l’energia chimica è in grado di compiere un lavoro (anche molto consistente) pensiamo agli esplosivi convenzionali: un’esplosione è una reazione chimica molto rapida in cui, a partire da una sostanza solida che occupa poco spazio (l’esplosivo) si formano sostanze gassose che ne occupano moltissimo, espandendosi e travolgendo tutto ciò che trovano nel loro cammino. Inoltre la reazione libera anche energia termica.

Un secondo esempio in cui possiamo osservare energia immagazzinata sotto forma di energia chimica liberarsi compiendo un lavoro è un generatore elettrochimico, per esempio una batteria. Pensiamo per esempio ad un avvitatore elettrico ed al lavoro che esso può compiere al nostro posto: la capacità di svolgere questo lavoro deriva dall’energia chimica immagazzinata all’interno della sua batteria. Nell’immagine sotto è possibile osservare l’interno della batteria del mio avvitatore: essa è costituita da alcuni piccoli generatori elettrochimici chiamati “pila mezza torcia” collegati tra loro in serie.

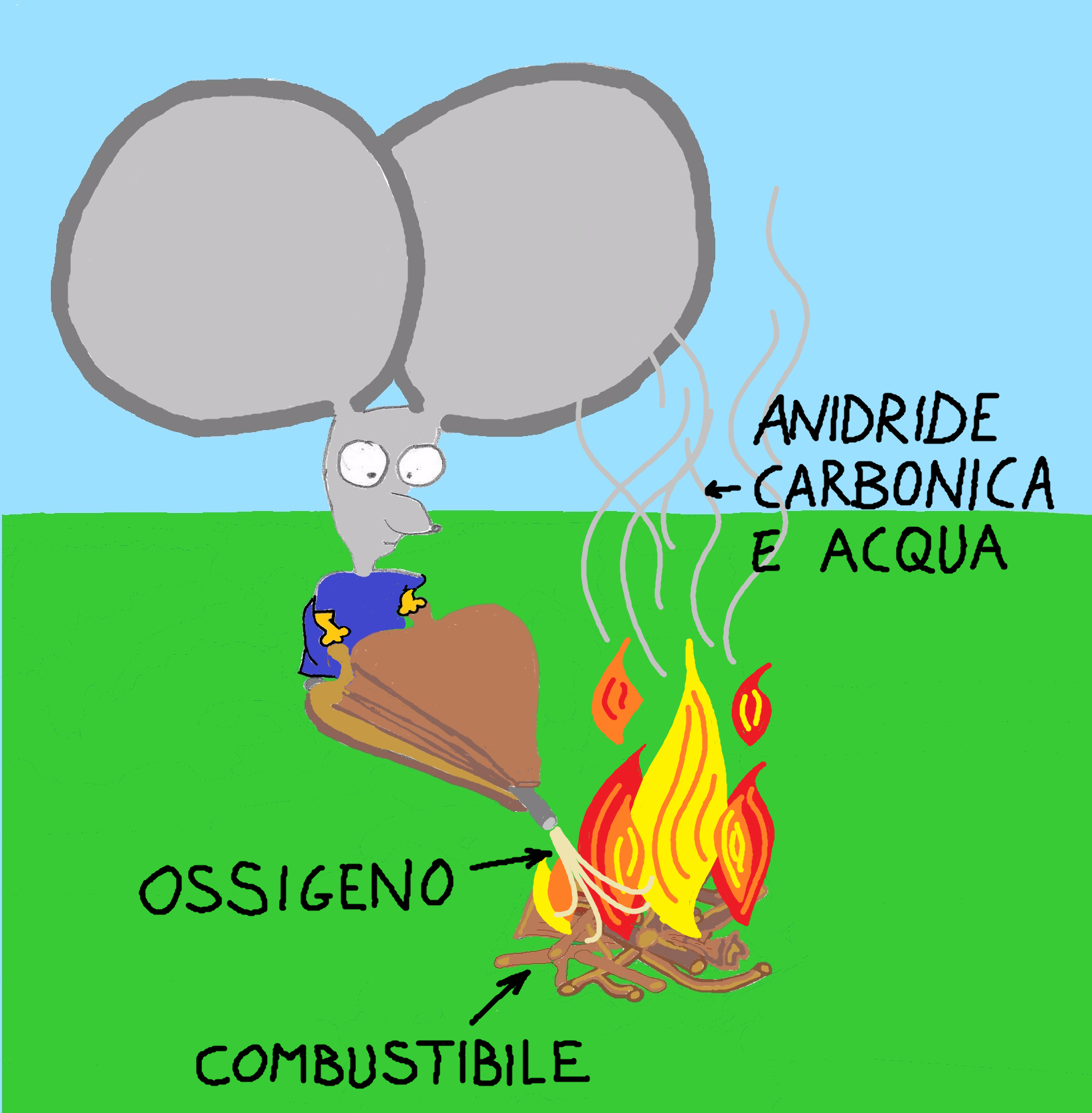
Come terzo esempio in cui possiamo osservare energia immagazzinata sotto forma di energia chimica consideriamo i combustibili (carbone, legna, benzina, metano, gpl, ecc.). Si tratta di sostanze chimiche in cui i legami chimici sono ad un alto livello di energia. Quando bruciano avviene la reazione di combustione: gli atomi del combustibile si combinano con gli atomi di ossigeno (indispensabili per far avvenire la reazione) dando luogo a molecole (anidride carbonica e acqua) in cui i legami chimici sono ad un basso livello di energia. L’energia in eccesso si libera sotto forma di calore, energia luminosa ed energia meccanica.
COMBUSTIONE: combustibile + ossigeno —> anidride carbonica + acqua + energia
Infine un ultimo esempio: bisogna ricordare che anche gli alimenti contengono energia sotto forma di energia chimica. Le tabelle nutrizionali degli alimenti ci dicono quanta energia viene fornita all’organismo mangiando una quantità unitaria di un determinato cibo. L’unità di misura utilizzata è il kilojoule (kJ), ossia un migliaio di joule. La caloria, che non è più l’unità di misura ufficiale dell’energia, viene ancora utilizzata moltissimo in riferimento agli alimenti e soprattutto il suo multiplo kilocaloria (kcal), ossia un migliaio di calorie. All’interno del nostro corpo i carboidrati prendono parte ad una reazione molto simile a quella della combustione, chiamata respirazione e, anche se non si sviluppa nessuna fiamma, si libera energia che viene utilizzata per il movimento, per mantenere la temperatura costante, ecc.
RESPIRAZIONE: carboidrati + ossigeno —> anidride carbonica + acqua + energia

Ma ricordatevi: non esagerate!

Tecnologia dell’energia: L’energia – Parte 1: Definizione; L’energia – Parte 2: Il principio di equivalenza massa-energia; Statistiche dell’energia; L’energia chimica; L’energia nucleare; L’energia elettrica; L’energia meccanica; L’energia – Parte 3: Il primo principio della termodinamica; Il generatore elettrochimico; Il generatore elettromeccanico; Circuito elettrico; Intensità di corrente elettrica; Tensione elettrica; Resistenza elettrica; La prima legge di Ohm; Il telegrafo; Teoria